您现在的位置是:首页 > 行业发展
《化学必修第二册》——12、化学电池
智慧创新站
2025-05-13【行业发展】17人已围观
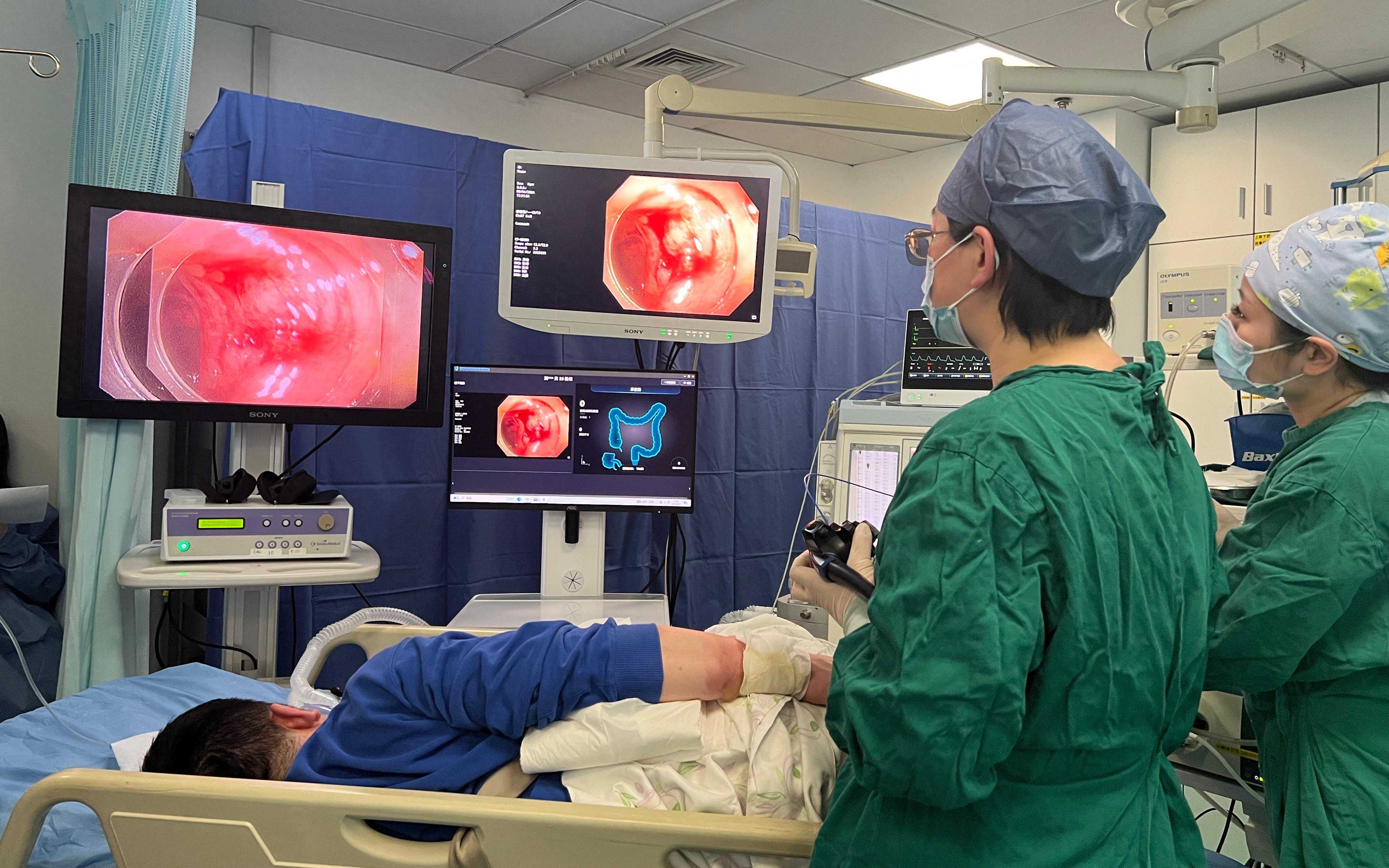
简介根据原电池的工作原理,人们研制出了很多结构和性能各异的化学电源,以满足不同的用电需要。1、一次电池特点:只能一次性使用,电池放电后不能充电,即电池的氧化还原反应不能逆向进行。如,锌锰干电就是一次电池,其结构如图。电池以锌筒为负极,石墨为正极,两极之间填充氯化铵、二氧化锰的糊状作电解质溶液。锌锰干电池...
根据原电池的工作原理,人们研制出了很多结构和性能各异的化学电源,以满足不同的用电需要。
1、一次电池特点:只能一次性使用,电池放电后不能充电,即电池的氧化还原反应不能逆向进行。如,锌锰干电就是一次电池,其结构如图。
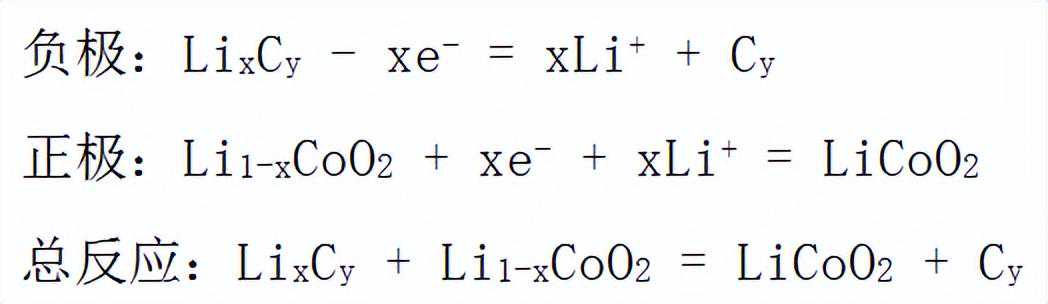
电池以锌筒为负极,石墨为正极,两极之间填充氯化铵、二氧化锰的糊状作电解质溶液。
锌锰干电池在使用过程中,锌会逐渐溶解,外壳变薄,内部糊状电解质会泄露,腐蚀电器。为了延长电池的使用寿命,提高其性能,将电解质换成碱性的KOH,制成了碱性锌锰干电池。
2、二次电池(充电电池)特点:电池在放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电、充电的循环。
常见的二次电池有铅酸电池、镍氢电池、锂离子电池等。
铅酸电池常用作汽车电瓶,其构造如图。以铅(Pb)作负极,强氧化性的二氧化铅(PbO2)作正极,稀硫酸作电解质溶液。
铅酸电池工作时的总反应、放电时的电极反应为:
锂离子电池:
以金属锂作负极,以钴酸锂作正极(不同锂离子电池所用正极不同),电解质用可导电的非水溶液,不能用水溶液(锂很活泼与水、氧气能剧烈反应)。其放电时的电极反应式和总反应式为:
手机、笔记本电脑、照相机和摄像机等所用的电池大多数为锂离子电池。
3、燃料电池一个燃烧反应可以设计成燃料电池。让燃料(如氢气、甲烷、乙醇等)在负极上失电子,氧化剂(一般用氧气)在正极上得电子。
特点:燃料电池清洁、安全、高效,其污染小,能量转化率可以达到80%以上。反应物不是储存在电池内部,而是从外部提供,供电量易于调节。
氢氧燃料电池:
以氢气作燃料,在负极失电子,氧气作氧化剂,在正极得电子。总反应为2H2+O2=2H2O。
氢氧燃料电池在不同电解质中的总反应相同,但正、负极反应式不同。
注意:书写电极反应式时,要结合电解质环境,并遵守离子方程式的书写规则。酸性环境中用氢离子和水平衡,不能出现氢氧根离子;碱性环境中用氢氧根离子和水平衡,不能出现氢离子。电极反应式要遵守质量守恒、电荷守恒。
很赞哦!(9)